Le laboratoire d'Hai-Tao HE et Didier MARGUET du Centre d'Immunologie de Marseille-Luminy en association avec les équipes de recherche de Christophe LAMAZE de l'Institut Curie et de Céline GALÈS de l’Institut des Maladies Métaboliques et Cardiovasculaires de Toulouse ont publié conjointement une étude interdisciplinaire dans le journal Cell du 11 août 2016. Ces travaux décryptent le dysfonctionnement de mécanismes moléculaires impliquant l'interféron ɤ (IFNɤ), protéine clé de la défense immunitaire, qui est incapable de remplir sa fonction naturelle de cytokine protectrice lorsque son récepteur est «amarré » au mauvais endroit dans la membrane des cellules: une modification de la réponse immunitaire à l'origine d'infections sévères souvent mortelles chez les jeunes enfants.
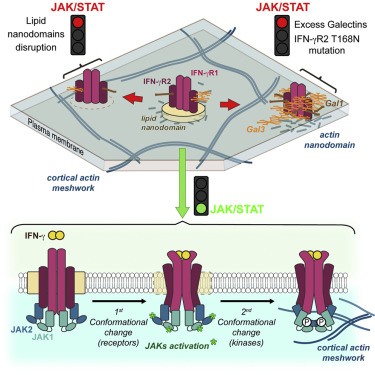 L’interféron ɤ (IFNɤ) souvent décrit comme "la cytokine star" de la défense immunitaire, est une protéine produite en réponse à une attaque virale, tumorale ou infectieuse. Comme tous les interférons, l’IFNɤ est susceptible de déclencher une réaction immune en se fixant à un récepteur spécifique présent à la surface de certaines cellules ce qui a pour effet d'activer la voie de signalisation JAK/STAT. Contrairement aux autres interférons, l’IFNɤ n’a nullement besoin d’entrer dans la cellule pour y remplir sa mission, en revanche il doit être localisé dans des régions spécifiques de l’ordre de quelques nanomètres de diamètre de la membrane cellulaire pour déclencher la réaction en chaîne qui aboutira à la stimulation de la réponse immunitaire.
L’interféron ɤ (IFNɤ) souvent décrit comme "la cytokine star" de la défense immunitaire, est une protéine produite en réponse à une attaque virale, tumorale ou infectieuse. Comme tous les interférons, l’IFNɤ est susceptible de déclencher une réaction immune en se fixant à un récepteur spécifique présent à la surface de certaines cellules ce qui a pour effet d'activer la voie de signalisation JAK/STAT. Contrairement aux autres interférons, l’IFNɤ n’a nullement besoin d’entrer dans la cellule pour y remplir sa mission, en revanche il doit être localisé dans des régions spécifiques de l’ordre de quelques nanomètres de diamètre de la membrane cellulaire pour déclencher la réaction en chaîne qui aboutira à la stimulation de la réponse immunitaire.
L'hyperglycosylation du récepteur de l'IFN-ɤ responsable d'un dysfonctionnement de la réponse immunitaire
Christophe LAMAZE, Directeur de recherche INSERM à l’Institut Curie a établi par le passé le rôle clé de l'IFNɤ dans le syndrome de prédisposition mendélienne aux infections mycobactériennes (MSMD). Le récepteur de l'IFNɤ comprend deux chaines protéiques auxquelles sont accrochées en général 6 sucres. Or il en possède 7 chez certains patients atteints par cette pathologie. C'est donc ce simple gain de glycolysation qui perturbe à lui seul la réponse immunitaire contre les mycobactéries: "Une modification en apparence anodine du récepteur de l’IFNɤ est responsable de cette pathologie puisque le récepteur est hyperglycosylé. Les enfants atteints par cette maladie génétique présentent une susceptibilité aux mycobactéries peu virulentes, telles que le bacille de Calmette et Guérin (BCG) et des mycobactéries environnementales, et souffrent d’infections sévères à répétition " explique C. LAMAZE
Comprendre une maladie génétique en étudiant la façon dont se déplacent les molécules
L’équipe d’Hai-Tao HE et Didier MARGUET du Centre d’Immunologie de Marseille-Luminy (Aix–Marseille Université/Inserm/CNRS) s'est associée à cette étude en y apportant son expertise en biophysique. Cette équipe a développé une approche de spectroscopie de corrélation de fluorescence (spot variation Fluorescence Correlation Spectrocopy en anglais) qui permet d’étudier le mode de diffusion des molécules à la surface des cellules. Le résultat des analyses montre l’existence de nanodomaines (régions de la membrane de quelques millionièmes de millimètres de diamètre) et leur rôle fondamental dans les phénomènes de signalisation. « C’est complètement inattendu que la présence d'un seul sucre supplémentaire suffise à modifier la façon dont le récepteur de l'IFNɤ se répartit à la surface des cellules, affectant ainsi très largement la cascade d’évènements en aval» explique Hai-Tao HE. « Ainsi altéré, le récepteur de l’IFNɤ est délocalisé vers un autre type de nanodomaine membranaire séquestré par des protéines, les galectines, qui se lient à ce sucre supplémentaire » ajoute Yannick HAMON.
Considérer les galectines comme une cible thérapeutique est une perspective séduisante, d’autant qu’éteindre l’expression de ces protéines annule in vitro l'effet pathologique associé au gain de glycolysation du récepteur de l'IFNɤ. Les chercheurs rappellent ainsi que les mutations de ce type représentent jusqu'à 1,4 % des mutations responsables de maladies génétiques. Cependant, ils soulignent que le développement de programmes thérapeutiques à l'attention de ces malades passe par l'exploration et la compréhension des mécanismes moléculaires du vivant en conjuguant les compétences de biologistes, de médecins, mais également de mathématiciens et physiciens, comme cela a été le cas pour cette découverte.
SOURCE: http://www.cell.com/cell/fulltext/S0092-8674(16)30909-6
http://dx.doi.org/10.1016/j.cell.2016.07.003
VIDEO LINK: http://www.cell.com/cell/abstract/S0092-8674(16)30909-6?innerTabvideo-abstract_mmc3
AUTHORS: Cédric M Blouin, Yannick Hamon, Pauline Gonnord, Cédric Boularan, Jérémy Kagan, Christine Viaris de Lesegno, Richard Ruez, Sébastien Mailfert, Nicolas Bertaux, Damarys Loew, Christian Wunder, Ludger Johannes, Guillaume Vogt, Francesc-Xabier Contreras, Didier Marguet, Jean-Laurent Casanova, Céline Galès, Hai-Tao He, Christophe Lamaze.