Comprendre les mécanismes de la tolérance des lymphocytes T afin de développer des stratégies innovantes pour prévenir et traiter les pathologies auto-immunes.
Le système immunitaire a la remarquable capacité de discriminer le soi du non-soi. L'absence ou le contrôle des réponses immunitaires vis-à-vis de nos tissus est appelée « tolérance immunologique ». Ce processus essentiel prévient de potentielles attaques des cellules immunitaires envers nos tissus. Une dérégulation entraîne l'apparition de pathologies auto-immunes qui touchent 5 à 10% de la population. Le thymus joue un rôle essentiel dans l’établissement de la tolérance des lymphocytes T, acteurs majeurs du système immunitaire par leur capacité à combattre les infections et les tumeurs.
Magali Irla et son équipe visent à caractériser les acteurs cellulaires de la tolérance immunitaire et à comprendre leurs mécanismes moléculaires afin d’identifier de nouvelles stratégies thérapeutiques pour les maladies auto-immunes et la régénération du système immunitaire.
Le thymus, organe lymphoïde primaire, coordonne les processus développementaux conduisant à la génération de lymphocytes T matures fonctionnels et non-réactifs vis-à-vis du soi. La mise en place de la tolérance des cellules T dans cet organe se caractérise par deux processus majeurs:
- L'élimination de cellules T autoréactives, reconnaissant des antigènes du soi. Ce processus est appelé délétion clonale ou sélection négative.
- La génération de lymphocytes T régulateurs (Treg) qui possèdent la capacité unique à contrôler les cellules T autoréactives ayant échappé à la sélection thymique. Les Treg jouent ainsi un rôle essentiel dans le maintien de la tolérance en périphérie.
Ces deux processus ont lieu principalement dans la médulla du thymus qui est composée d'un réseau dense de cellules épithéliales médullaires thymiques (mTEC) et de cellules dendritiques (DC). Les mTEC jouent un rôle clé dans la sélection des cellules T grâce à leur fascinante capacité à exprimer des milliers d'antigènes spécifiques de tissus périphériques (appelés auto-antigènes). L'expression de ces auto-antigènes est régulée notamment par les facteurs de transcription Aire et Fezf2.
Les DC participent également à la mise en place de la tolérance des cellules T en présentant des auto-antigènes exprimés par les mTEC et en transportant dans le thymus des antigènes inoffensifs capturés en périphérie. Ainsi, les mTEC et les DC collaborent étroitement pour générer des lymphocytes T fonctionnels non-autoréactifs ainsi que des cellules Treg.
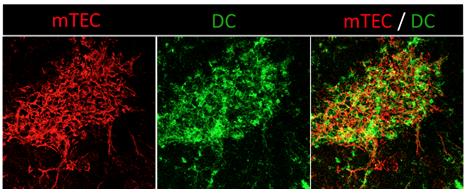
La médulla thymique, site de la tolérance des cellules T, est composée d'un réseau dense de mTEC et de DC. Image de microscopie confocale d'une coupe de thymus montrant les mTEC (anti-kératine 14, rouge) et les DC (anti-CD11c, vert). Copyright : Magali Irla, CIML.
De manière réciproque, les cellules T en développement, appelées thymocytes, contrôlent la différenciation et l'organisation des mTEC. Ce phénomène d'échange bidirectionnel est appelé « crosstalk thymique ». Dans ce contexte, l'équipe a montré que les thymocytes de type CD4+ jouent un rôle clé non seulement dans le développement de mTEC fonctionnelles exprimant le facteur de transcription Aire mais également dans l'organisation 3D de la médulla thymique.
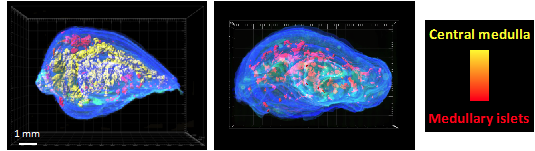
Les thymocytes CD4+ contrôlent l’organisation 3D de la médulla thymique. Reconstruction 3D de lobes thymiques de souris sauvages (image de gauche) et de souris H2A-a-/- dépourvues en thymocytes CD4+ (image de droite) à l'aide de notre algorithme For3D (Full organ reconstruction in 3D). Les îlots médullaires sont représentés par couleur en fonction de leur volume, du rouge (les plus petits) au jaune (le plus grand). Copyright: Irla et al. Journal of Immunology 2013.
L’équipe tente aujourd’hui de mieux comprendre l’impact des thymocytes sur le développement des différents sous-types de mTEC et l’expression des auto-antigènes dans une perspective de médecine régénérative. Par ailleurs, les cellules Treg sont très prometteuses en thérapie cellulaire pour traiter les pathologies autoimmunes et induire la tolérance dans le cadre de transplantation. C’est pourquoi nous étudions leur développement dans le thymus et cherchons à identifier des molécules qui contrôlent leur activité suppressive et anti-inflammatoire afin de faciliter leur utilisation en clinique. Pour cela, nous utilisons plusieurs modèles murins précliniques d'auto-immunité et de greffe.
Régénération de la fonction thymique
La fonction thymique est altérée par les traitements myéloablatifs couramment utilisés pour traiter des maladies hématologiques par transplantation de cellules souches hématopoïétiques. En outre, au cours du vieillissement, cet organe subit des changements progressifs dans son architecture et sa composition, phénomène appelé « involution thymique ». Les traitements myéloablatifs et le vieillissement ont des effets délétères sur les TEC, conduisant à une production fortement réduite en lymphocytes T et par conséquent à une susceptibilité accrue aux infections opportunistes, à l'auto-immunité et à l’apparition de cancers.
Il est ainsi essentiel d’identifier des molécules capables de régénérer le thymus, organe présentant une grande plasticité. Notre équipe cherche à définir de nouvelles stratégies thérapeutiques pour stimuler la régénération du thymus et la production des cellules T afin d’améliorer l'immunité T dans de nombreuses conditions physio-pathologiques.