Le thème général du laboratoire est la compréhension des voies de signalisation cellulaire et des mécanismes transcriptionnels qui régulent la polarisation fonctionnelle des macrophages et des cellules dendritiques (DC) dans l'inflammation et l'immunité. L'activation des macrophages et des DC par les récepteurs microbiens de reconnaissance de formes, tels que les récepteurs Toll like receptors (TLRs), est essentielle pour l'immunité innée et adaptative et a fait l'objet d'études approfondies. Cependant, ces cellules jouent également un rôle important dans la résolution de l'inflammation, le maintien de l'homéostasie tissulaire et la tolérance immunitaire, mais nous comprenons relativement peu de choses sur les voies de signalisation et les mécanismes moléculaires qui médient les fonctions des macrophages et des CD dans ce contexte. Dans les maladies infectieuses et le cancer, ces mécanismes favorisent l'évitement de l'immunité protectrice et la progression de la maladie. D'autre part, la non-régulation de ces mécanismes peut également conduire à des maladies inflammatoires chroniques et à l'auto-immunité.
Nos travaux antérieurs ont montré que le facteur de transcription pro-inflammatoire prototype, Nuclear Factor-kappaB (NF-kappaB), joue un rôle important dans la résolution de l'inflammation en limitant l'activation des macrophages pendant l'infection. Dans des études parallèles, nous avons montré que l'activation de NF-kappaB dans les macrophages, tumour-associated macrophages (TAM) maintenait un phénotype anti-inflammatoire associé à la progression tumorale et à la suppression de l'immunité anti-tumorale. Plus récemment, nous avons découvert que l'activation à médiation IKKbeta de la voie canonique NF-kappaB joue un rôle critique dans la maturation de la conversion des DC tolérogènes et des cellules T régulatrices (Treg) - nécessaire pour maintenir la tolérance périphérique et l'homéostasie immunitaire. Nos études en cours se concentrent sur la caractérisation des voies de signalisation dans les macrophages et les CD qui dictent l'équilibre entre les fonctions pro-inflammatoires et anti-inflammatoires ou immuno-stimulatoire et l'activité immunostimulatrice par opposition à l'activité immunosuppressive.
Projets spécifiques:
1) NF-kappaB et voies de signalisation associées dans la maturation fonctionnelle des DC dans la tolérance et l’immunité (Contact principal ; Toby Lawrence).
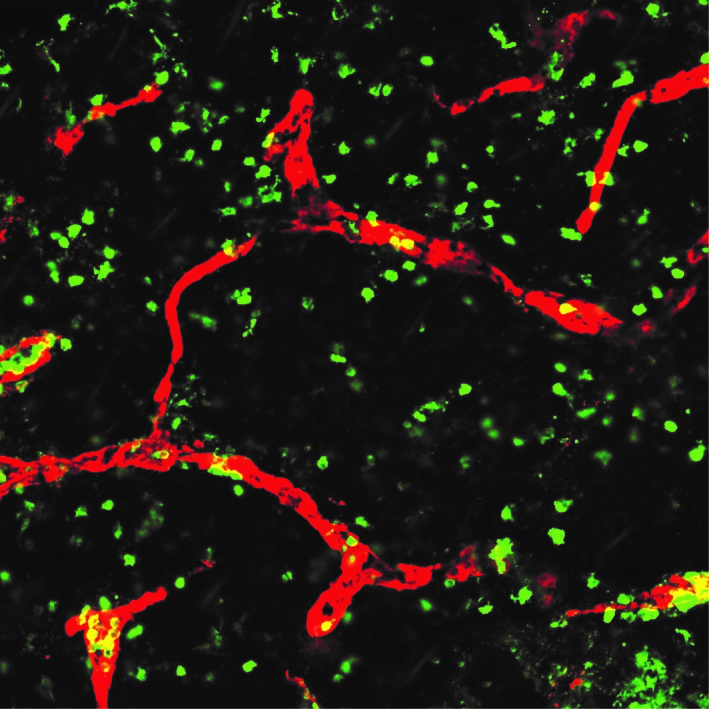
Image de DC (en vert) dans la peau qui pénètre dans les vaisseaux lymphatiques (en rouge). Ces cellules des tissus non lymphoïdes (NLT)-DC patrouillent les tissus et migrent vers les ganglions lymphatiques drainant à travers la lymphe où ils peuvent présenter des antigènes aux cellules T naïves. A l'état d'équilibre, ce processus est important pour la tolérance aux antigènes dans les tissus. Mais les signaux instructifs qui déclenchent la maturation des NLT-DC et la migration en régime permanent demeurent une énigme. Ce projet vise à démêler ces mécanismes et à caractériser les voies qui régulent les fonctions tolérogènes des DC.
2) Ontogénie et fonction des macrophages associés aux tumeurs (TAM) et leur contribution à la progression du cancer (Contact principal ; Toby Lawrence).
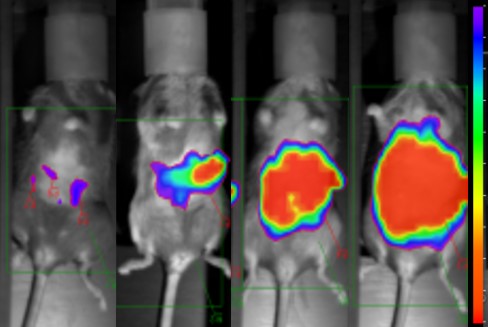
Souris qui ont reçu une injection de cellules cancéreuses ovariennes qui expriment la luciférase de luciole, ce qui permet l'imagerie de la croissance et de la distribution des tumeurs chez les souris vivantes. Les études ont montré que les cellules cancéreuses ovariennes colonisent l'épiploon, un petit morceau de tissu adipeux dans la partie supérieure gauche de l'abdomen. L'épiploon est densément peuplé de macrophages exprimant le CD163. Image Toby Lawrence/CIML
Vidéo de l'imagerie complète de l'épiploon avec un nodule de tumeur ovarienne (blanc), les adipocytes sont colorés en rouge et les macrophages CD163+ en vert). Nos études montrent que les macrophages CD163+ dans l'épiploon favorisent l'activité invasive des cellules cancéreuses ovariennes et la progression de la maladie. Actuellement, nos travaux visent à disséquer les mécanismes des interrelations entre les macrophages CD163+ et les cellules cancéreuses, favorisant la progression tumorale. Vidéo Toby Lawrence/CIML
3) Le rôle de l'activation IKKbeta en aval des mutations oncogènes-pilotes dans la formation du microenvironnement immunosuppresseur dans le cancer (Contact principal ; Nathalie Auphan-Anezin).
4) Autophagie et signalisation immunitaire innée dans les macrophages et les DC (Contact principal ; Magali Bebien).