Géolocalisation et fonctions d’une nouvelle famille de lymphocytes
Chez les mammifères, le fonctionnement du système immunitaire inné est assuré par un large spectre de cellules spécialisées : cellules dendritiques, polynucléaires, monocytes, macrophages, granulocytes et cellules NK. Ensemble, elles constituent un système de défense rapide d’une redoutable efficacité et enclenchent la réponse de l’immunité adaptative.
Les cellules lymphoïdes innées (ILC, pour Innate Lymphoïd Cells) sont les derniers membres de la famille à avoir été décrits. Elles sont en quelque sorte une « version rapide » des lymphocytes T. Réparties en différents groupes, elles ont une morphologie de cellule lymphoïde, produisent les mêmes cocktails de cytokines que les lymphocytes T mais, à l’instar de leurs congénères de l’immunité innée, elles sont dépourvues de récepteurs spécifiques aux antigènes. Serge Van des Pavert et son équipe s’intéressent tout particulièrement au troisième sous-groupe d’ILCs, les ILC3, impliqué dans le développement des organes lymphoïdes secondaires. En hébergeant l’étape de présentation antigénique de pathogènes aux lymphocytes T matures, ces organes périphériques jouent un rôle majeur au sein du système immunitaire adaptatif.
D’un point de vue fonctionnel, les ILCs se classent en deux catégories : les cellules tueuses NK et les ILCs dites auxiliaires qui relaient les signaux d’activation vers d’autres cellules immunitaires. Selon les molécules qu’elles expriment (marqueurs de surface, facteurs de transcription et cytokines), ces dernières sont elles-mêmes divisées en trois sous-groupes : les ILC1s qui expriment le facteur de transcription T-bet et produisent la cytokine IFNγ, les ILC2s qui expriment le facteur de transcription GATA-3 et produisent les mêmes cytokines que les lymphocytes T auxiliaires de type 2, et enfin les ILC3s dont le développement et la fonction dépendent du facteur de transcription RORγt.
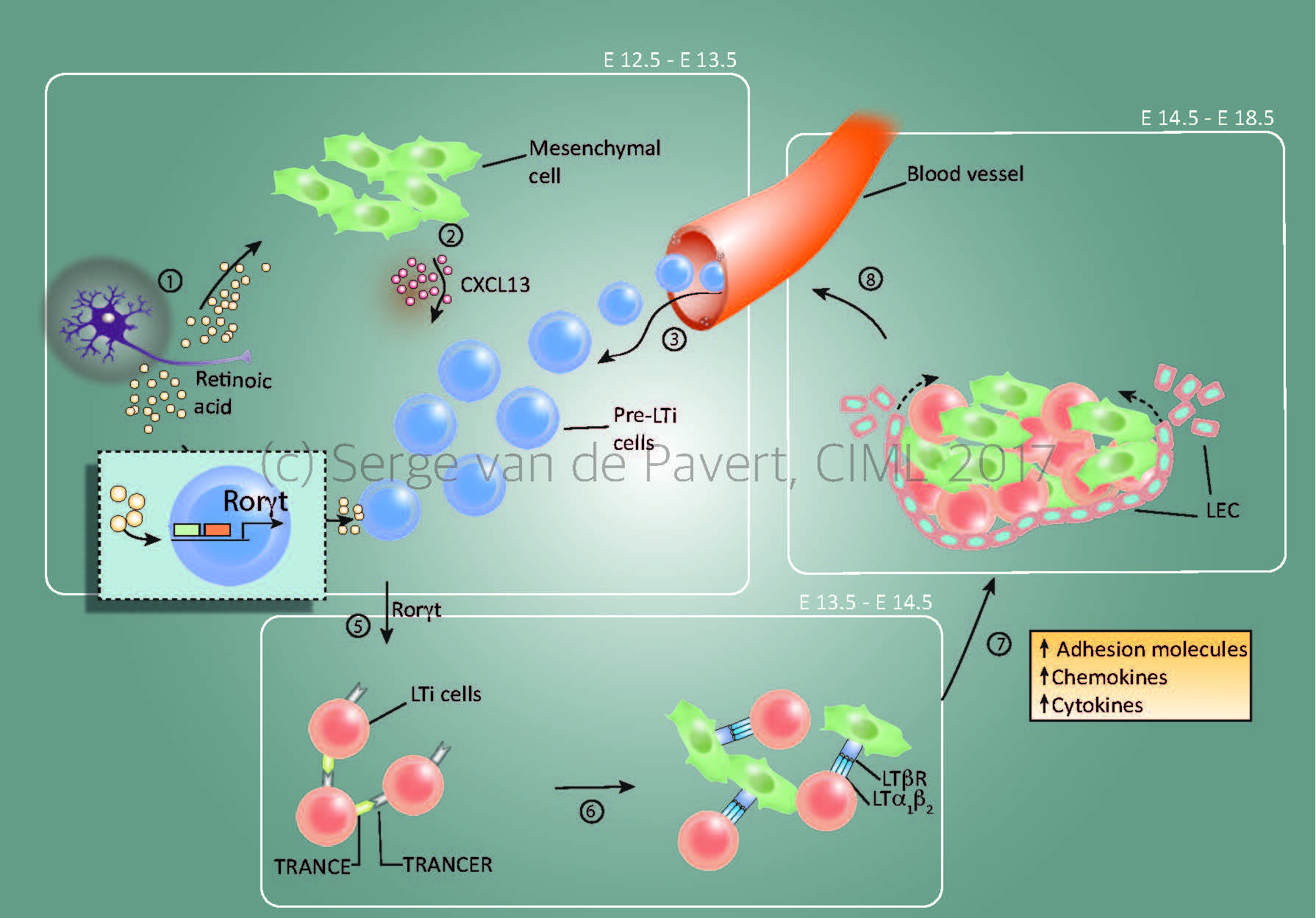
“Lymph node formation within the mouse embryo starts around E12.5 by Cxcl13 secretion by resident mesenchymal cells, under influence by retinoic acid. The stage at which the lymph node anlagen is initiated depends on the location within the embryo, with the most anterior lymph nodes (E12.5= cervical, mandibular, axillary) forming the first and the most posterior as last (E14.5/15.5= inguinal, popliteal). The presence of Cxcl13 and possibly other chemokines expressed by the mesenchymal cells, attract (pre-) Lymphoid Tissue Inducer (LTi) cells towards the niche. Within this niche, retinoic acid induces the essential nuclear transcription factor RORγt within the pre-LTi cells so that they mature into LTi cells, which can interact with the mesenchymal/stromal organiser cells via the lymphotoxin signalling pathway.
Expansion of the lymph node anlagen takes place after lymphotoxin signalling started (around E14.5 for the most anterior lymph nodes), with the attraction of more LTi cells, and thus more interactions with resident mesenchymal cells. Also, the mesenchymal cells produce Vegfc, a potent attraction molecule for lymphatic endothelial cells, which form a layer of lymphatic endothelial cells around the lymph node anlagen and eventually connect it to the lymphatic vasculature. At this stage, the chemokine Ccl21 expressed by the lymphatic endothelial cells and vasculature are important for the transport of LTi cells towards the lymph node anlagen.”
L’immunité adaptative : une protection axée sur le travail collectif
Les vaisseaux ainsi que les ganglions lymphatiques sont deux éléments clef de notre système de défense contre les pathogènes. Les premiers transportent les cellules et les petites molécules depuis la périphérie vers les deuxièmes, dans lesquels s’organise la réponse immunitaire spécifique. La localisation de ces organes est déterminante pour que cette dernière soit rapide et efficace. Ce n’est donc pas surprenant que les processus de formation des vaisseaux et les ganglions lymphatiques s’opèrent de façon coordonnée, dans une même fenêtre de temps et en partageant les mêmes signaux de différenciation.
Les ganglions lymphatiques se forment durant l’embryogénèse, et les premières étapes de ce processus impliquent l’interaction de (cellules progénitrices du mésenchyme) cellules organisatrices du mésenchyme avec les ILC3s au sein de sites spécifiques de notre organisme. Alors que les mécanismes qui conduisent à la formation embryonnaire de ganglions et des vaisseaux lymphatiques sont parfaitement connus, la question reste entière quant à la spécificité des lieux où vient se jouer le développement de ces organes. « En se basant sur nos résultats ainsi que sur des données préliminaires, les fibres nerveuses et les réseaux vasculaires adjacents pourraient jouer un rôle important » commente Serge van de Pavert. « Aujourd’hui, l’essentiel de mes recherches se concentre sur la caractérisation des acteurs majeurs du développement du système immunitaire, et plus particulièrement sur ceux impliqués dans la formation du système lymphatique. »
“Tu es ce que mange ta mère”
La formation des organes lymphoïdes secondaires dépend étroitement des ILC3s aussi appelées cellules inductrices du tissu lymphoïde (LTi pour lymphoid tissue inducer). Alors qu’il évoluait dans le groupe du Professeur Reina Mebius, Serge van de Pavert et ses collègues ont montré que la différenciation des ILC3s d’embryon de souris est contrôlée par la présence d’acide rétinoïque (RA pour retinoic acid), le produit métabolique de la vitamine A. Le RA « prépare » les progéniteurs des ILCs afin que ces dernières puissent interagir entre-elles, et il est important de noter que tout changement de concentration du RA perturbe considérablement cette organisation. On peut donc se poser la question suivante : est-ce que les mères ayant subi une carence en vitamine-A mettent au monde une progéniture aux capacités de défense immunitaire réduites ? « Il semblerait que ce soit le cas » souligne Serge van de Pavert « Nous avons observé que la taille des ganglions lymphatiques de ces souriceaux était anormalement petite ». Cette observation suggère qu’en plus de ses effets ravageurs sur les capacités physiques des mères et des enfants auxquels elle s’attaque, la malnutrition perturbe également le développement normal de leur réponse immunitaire.
Les neurones pourraient jouer un rôle dans la formation des ganglions lymphatiques
«Les ganglions lymphatiques se développent toujours aux mêmes emplacements, à proximité des grandes veines et aux embranchements des vaisseaux sanguins. Donc tout porte à croire que ces sites délivrent des signaux qui induisent le développement de ces organes. Des données récentes appuient l’hypothèse selon laquelle l’acide rétinoïque serait directement produit par des neurones présents dans l’environnement proche, ce qui démontre une nouvelle fois le lien étroit entre les systèmes nerveux et immunitaire. »
L’équipe entend aujourd’hui déterminer le rôle des ILC3s au sein de cet environnement, ce qui exige notamment de parfaire le phénotypage des différentes sous populations de cette nouvelle famille de lymphocytes. Si les chercheurs ont pu établir les grandes lignées d’ILCs, ils ne disposent toujours pas d’une carte précise ou figureraient à la fois leurs différents états de différenciation et les nombreuses interactions qu’elles établissent avec leur environnement. « Notre objectif est de mieux comprendre comment les ILC3s répondent aux multiples agressions et s’adaptent à leur environnement proche ». À cette analyse fonctionnelle vient s’ajouter une étude descriptive qui vise à cartographier l’environnement des ILC3s grâce à la microscopie à feuillet de lumière (LSFM, Light Sheet Fluorescence Microscopy). Cette technologie de pointe génère des coupes optiques d’échantillons vivants de grande taille et ce dans un temps record. Les informations 3D obtenues permettent ainsi de suivre en temps réel les interactions des ganglions lymphatiques avec leur environnement, notamment avec les cellules nerveuses et les vaisseaux sanguins.
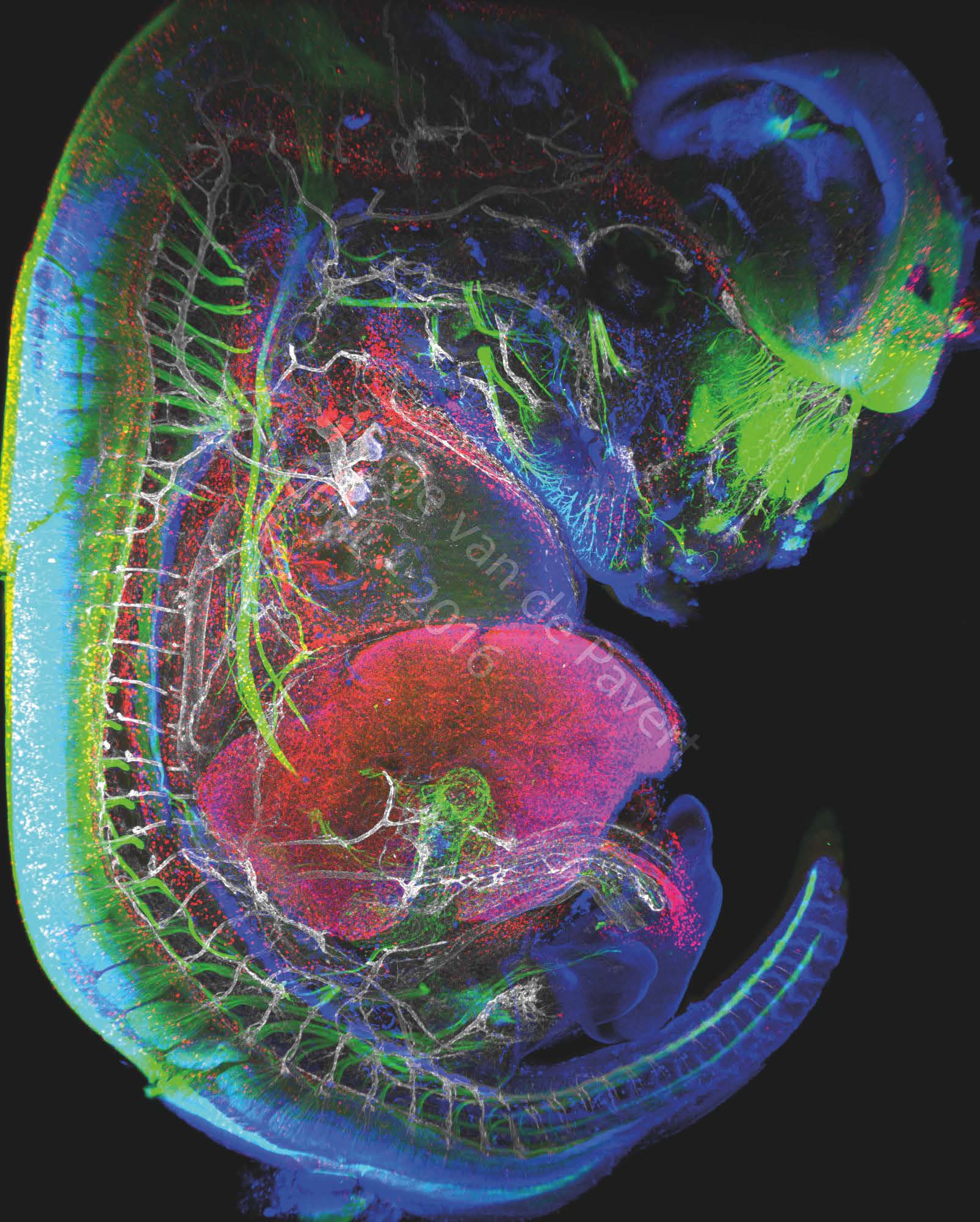
“ Le marquage immunofluorescent révèle les neurones (marquées au BetaIII Tubulin), les macrophages et les cellules endothéliales lymphatiques sont visibles en rouge (marqués au Lyve-1), les noyaux des neurones spécifiques et les cellules endothéliales lymphatiques sont marqués en bleu (marquage Prox1) et le réseau vasculaire en blanc (marquage Pecam-1). On peut observer l'œil de l'embryon ainsi que les neurones nasaux, en vert. A gauche, la moelle épinière est marquée en vert. Les vertèbres sont quant à elles visibles par le biais du marquage des ganglions de la racine dorsale, en vert, et des vaisseaux sanguins, marqués en blanc. Le cœur est visible juste au dessus du foie qui est marqué avec l'anticorps LYVE-1. L'intestin embryonnaire, non loin du foie, est visualisé par l'innervation des neurones, en vert. Le cordon ombilical est visualisé grâce aux vaisseaux sanguins blancs et aux macrophages voisins, marqués en rouge. Cette microscopie a été générée dans le cadre de recherches sur la formation des ganglions lymphatiques et du système lymphatique. Leur formation, amorcée au stade embryonnaire, peut être modifiée en changeant certains facteurs diététiques affectant la différenciation cellulaire. Ces visualisations ont donc pour but d'analyser les déplacements des cellules impliquées dans la formation du système lymphatique. ” Image : Serge van de Pavert/CIML