Comment les sentinelles de l’immunité traduisent les données microbiennes qu’elles reçoivent en instructions immunologiques ?
Présentes dans le sang, les muqueuses et les organes lymphoïdes, les cellules dendritiques assurent un double rôle de sentinelles mais aussi de chef d’orchestre du système immunitaire. Tapies dans les portes d’entrée empruntés par les pathogènes elles repèrent les agents infectieux, les ingèrent et relâchent des signaux biochimiques afin de l’alerter et attirer sur le lieux de l’infection les cellules de la la première ligne de défense de l’organisme.
Une fois l’intrus digéré, les cellules dendritiques exposent également à leur surface des fragments du pathogène : les antigènes. Elles migrent alors via les vaisseaux lymphatiques jusqu’aux organes lymphoïdes secondaires (rate, ganglions lymphatiques, tissus lymphoïdes associés aux muqueuses du tube digestif et des poumons) où elles présentent ces antigènes aux lymphocytes T et B. Une fois « armés » contre le pathogène, ces défenseurs de haute précision migreront à leur tour vers le site de l’infection pour assurer son éradication.
Dans cette séquence d’évènements, l’équipe de Philippe Pierre et d’Evelina Gatti, s’intéresse tout particulièrement à l’étape clef de la maturation de la cellule dendritique. L’instant où, la cellule détecte le microbe, change ses fonctions biologiques et commence sa migration vers les organes lymphoïdes secondaires.
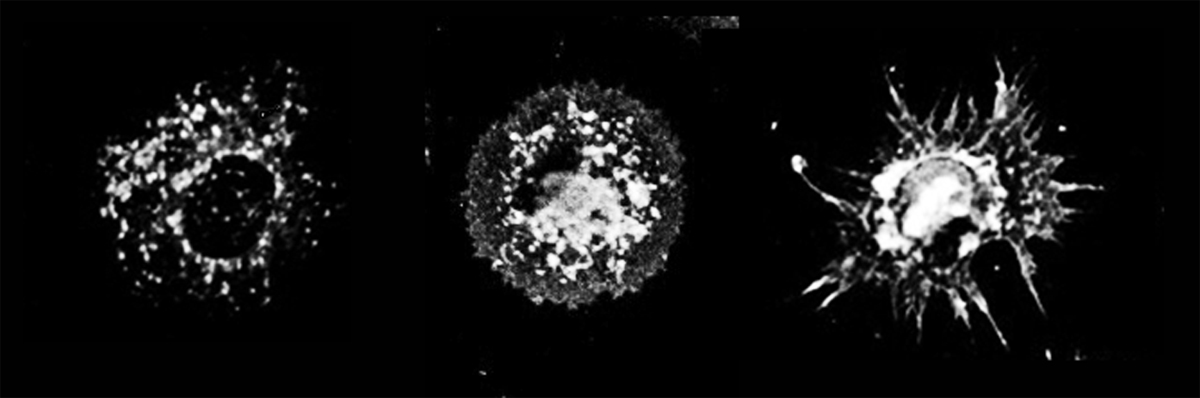 Génération d'une cellule dendritique. Copyright, P Pierre, CIML
Génération d'une cellule dendritique. Copyright, P Pierre, CIML
« La cellule dendritique fonctionne à l’instar d’une interface » rappelle Philippe Pierre. « Elle détecte les produits microbiens, les classe selon leur type puis convertie ces informations en instructions. Elle utilise ces instructions d’abord pour elle même - parce que la rencontre avec des produits microbiens n’est pas un événement anodin et génère naturellement un stress dans la cellule - mais aussi pour les cellules du système immunitaire avec lesquelles elle coopère.
Paradoxalement, alors que l’on connait depuis longtemps le rôle clef joué par ces cellules dans l’activation des lymphocytes B et T, que l’on a identifié les capteurs qui leur permettent de détecter les signaux de dangers émis par les pathogènes, le fonctionnement de cette interface reste en partie une énigme. Nous tentons de résoudre cette énigme, de comprendre comment la cellule dendritique convertie les « données microbiennes » en » instructions immunologiques ».
Pour délivrer cette « instruction immunologique », l’antigène (en pratique un peptide de quelques acides aminés), n’est pas présenté seul aux lymphocytes B et T par les cellules dendritiques mais niché dans une poche constituée par une molécule du soi (ces protéines du soi dites du Complexe Majeur d’Histocompatibilité sont appelées HLA chez l’homme). Retrouvées à l’identique chez toutes les cellules de l’individu, les protéines du CMH conditionnent ainsi la reconnaissance de l’antigène par les lymphocytes et donc leur activation au cœur des organes lymphoïdes secondaires. Logiquement, l’équipe s’est intéressée à la façon dont la cellule dendritique réoriente le transport de ces molécules en fonction de la nature des produits microbiens qu’elle a détectée.
"Sous notre microscope, toutes les cellules dendritiques changeaient
spectaculairement en réponse aux produits microbiens"
« En observant sous notre microscope le comportement des molécules du CMH dans les cellules dendritiques nous avons constaté que l’ajout de produits microbiens induisait des changements spectaculaires chez toutes les cellules de notre culture » précise Evelina Gatti, co-dirigeante de l’équipe sur ce sujet. « Initialement orientées vers l’intérieur, les molécules du CMH se tournaient soudainement vers l’extérieur de la cellule. Nous avons alors essayé de comprendre comment la cellule dendritique organisait le trafic des molécules du CMH. »
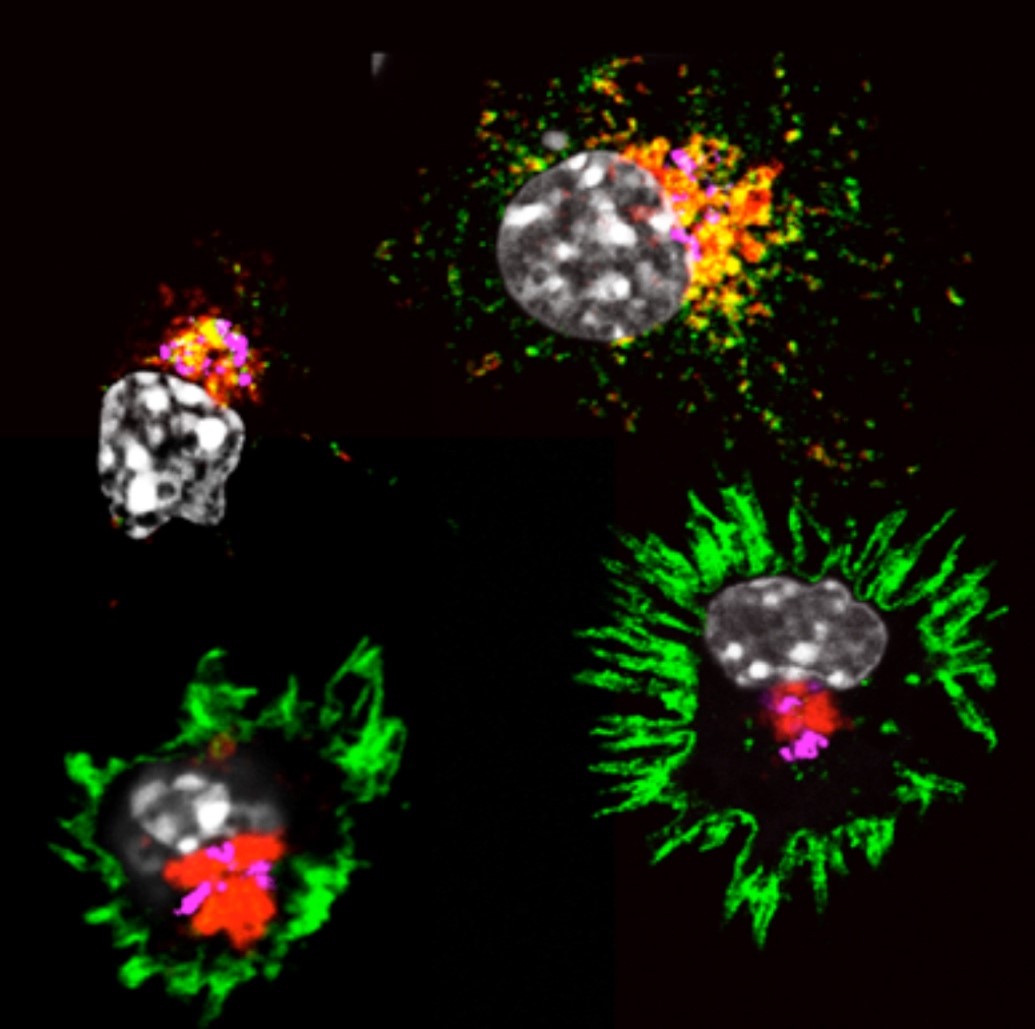
Activation des Cellules Dendritiques (Molécules du CMH II en vert, Lysosomes en rouge, noyaux en gris). Copyright, Alexis Combes, Philippe Pierre, CIML
Depuis ces observations l’équipe a intégré énormément de nouvelles donnés sur des voies biochimiques encore mal connues et impliquées dans l’acquisition des fonctions immunomodulatrices des cellules dendritiques. Nous avons ainsi découvert que des enzymes, des ubiquitine ligases de la famille des MARCH, réglaient l’adressage des molécules de CMH, en accordant à ces dernières un « ticket d’entrée » qui leur ouvre l’accès restreint à des compartiments spécialisés de la cellule. Là, les molécules de CMH rencontrent les antigènes du soi ou ceux du pathogène qui dicteront en retour la réponse du système immunitaire : l’indifférence bienveillante pour les premiers jugés comme inoffensifs, le montage d’une attaque ciblée contre la pathogène à la vue des seconds.
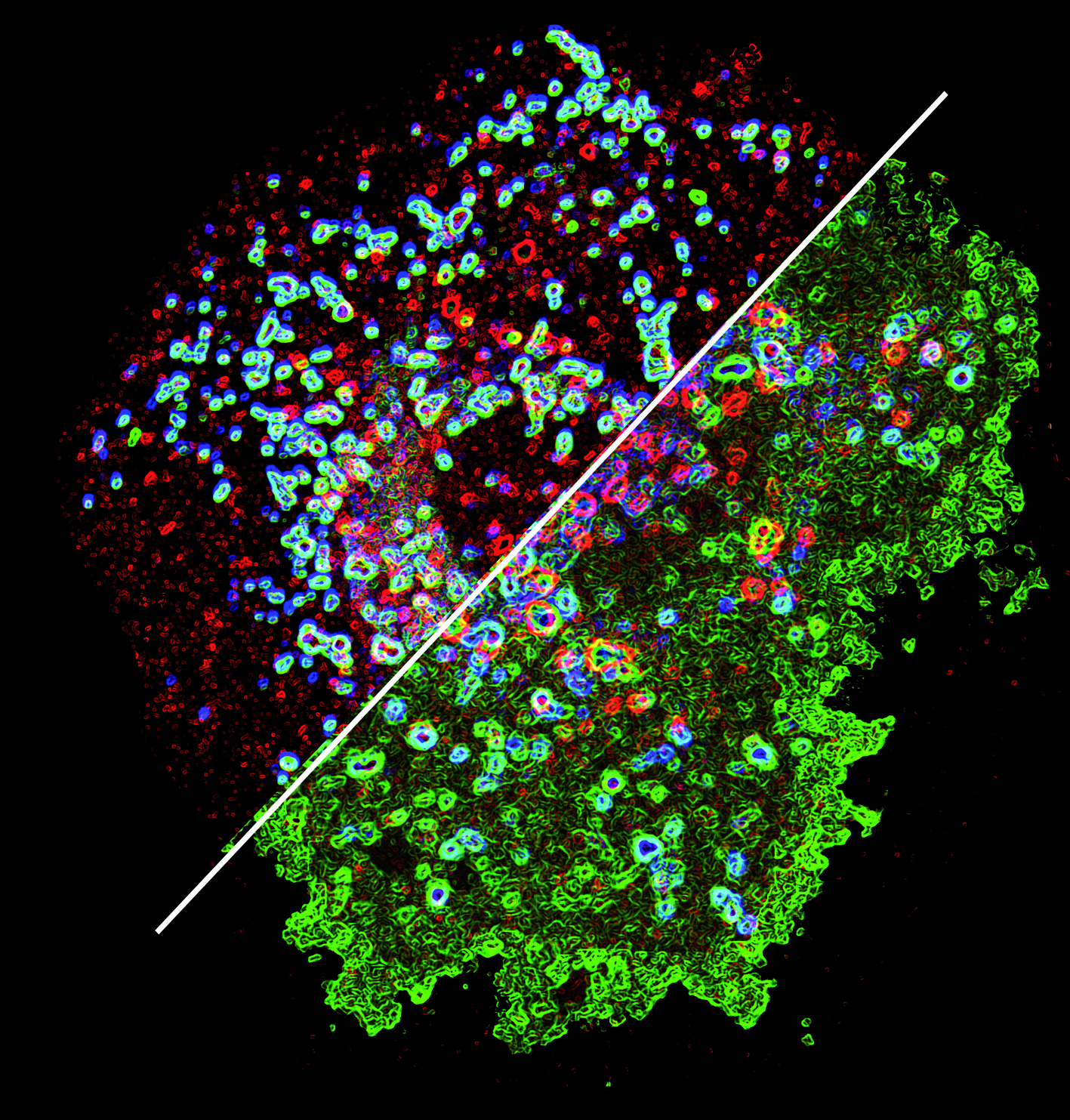
Modification de la distribution des antigènes des molécules du CMH 2 à l’intérieur d’une cellule dendritique en présence (en haut) ou en l’absence (en bas) de l'enzyme MARCH1. Copyright P Pierre, CIML.
L’équipe a pu aussi montrer que la molécule de type LAMP associée au cerveau et au DC (BAD-LAMP, C20orf103, LAMP5) est un chaperon pour les récepteurs toll-like (TLR) endocytiques exprimés spécifiquement dans les cellules dendritiques plasmacytoïdes humaines et qui sont spécialisés dans la détection d’acides nucléiques d’origine virale ou bactérienne. BAD-LAMP permet un adressage de ces récepteurs TLR dans des compartiments intracellulaires qui définissent spécifiquement la nature des signaux émis par ces récepteurs et donc la réponse choisie par le système immunitaire face à la menace microbienne détectée. BAD-LAMP est donc une molécule clé pour étudier la régulation de l'immunité innée humaine en réponse aux acides nucléiques et le biologie des TLRs qui sont fortement sollicités dans l’immunité anti-cancéreuse ou anti-virale et souvent déréglés dans un certain nombre de maladies auto-immunes.
Parallèlement, l’équipe a levé le voile sur la façon dont la synthèse protéique et des molécules faisant partie des mécanismes de réponse au stress sont nécessaires la coordination de l’activation des DCs en contrôlant notamment l’activation de génes codant pour des protéines messagères du système immunitaire ou anti-virales comme les Interférons de type I ou le TNF, ainsi que leur relargage extra-cellulaire .
« Dans la cellule dendritique la reconnaissance de produits microbiens, l’utilisation de voies de stress et la régulation de la traduction sont étroitement connectées. C’est sur cette mécanique complexe que repose la rapidité et la finesse de sa réponse » soulignent Philippe Pierre et Evelina Gatti. « Sous l’effet de ces interactions, certaines molécules sont présentées à la surface de la cellule, d’autres non, d’autres encore empruntent une voie différente avant d’être capturées par autophagie (un processus d’auto-cannibalisme qui permet à la cellule d’éliminer des amas de protéines superflus ou des constituants endommagés ou surnuméraires). »
L’équipe tente aujourd’hui de mieux comprendre le fonctionnement de chacune de ces voies et espère prochainement parvenir à les manipuler à des fins thérapeutiques. À les ralentir afin de réduire l’hyperactivité du système immunitaire à l’origine des maladies auto-immunes ou, au contraire, à les accélérer pour améliorer l’efficacité des vaccins contre les maladies infectieuses.