Un sens inné du danger
Chez l'homme, la famille des récepteurs Toll (Toll-Like Receptor ou encore TLR) compte une petite dizaine de membres, numérotés de 1 à 10. Leur fonction commune, remarquablement conservée au cours de l’évolution, est de détecter les signaux témoignant qu’une infection est en cours. Les TLRs sont utilisés par les cellules immunitaires résidant principalement dans la peau et les muqueuses, voies d’entrées naturelles des pathogènes.
Pour faire face à des menaces infectieuses très variées, les TLRs présentent une vaste hétérogénéité de structures et de localisations. Une fois repérés les signaux microbiens, ces capteurs propagent un signal via différentes voies jusqu’au noyau de la cellule où ils activent les gènes qui orchestrent la réponse immunitaire de type inflammatoire.
Lena Alexopoulou étudie les mécanismes de protection contre les infections portés par les TLRs. Elle a contribué à l’identification des signaux perçus par un certain nombre d’entre eux, leur origine (virale ou bactérienne) et leur rôle dans la protection contre différentes maladies.
Aujourd’hui, son équipe se focalise sur deux aspects de la biologie des TLRs : leur implication dans les maladies auto-immunes et les mécanismes de coopération entre différents membres de cette famille.
Les signaux microbiens détectés par les TLRs sont très voisins de ceux libérés par nos propres cellules lorsqu’elles sont endommagées ou mourantes. Ainsi, les infections sont parfois associées à des réactions exacerbées contre les cellules de l’organisme, selon un mécanisme dit auto-immun.
L"auto-immunité, effet secondaire du (dys)fonctionnement des TLRs
Dans une maladie auto-immune, le système immunitaire déréglé réagit contre l’organisme qu’il est censé protéger : des composants du soi sont anormalement identifiés comme étrangers par le système immunitaire. Conséquence, ce dernier attaqtue des cellules normales de l’individu. Des auto-anticorps sont retrouvés dans le sang des malades, signatures de cette auto-réactivité délétère.
Des études récentes ont démontré le rôle de l’activation de TLRs dans la genèse de certaines maladies auto-immunes, en particulier du lupus érythémateux disséminé (LED). Le LED est une maladie auto-immune chronique caractérisée par la production massive d’auto-anticorps dirigés contre des éléments du noyau des cellules, conduisant à des atteintes cutanées, articulaires ou vasculaires viscérales dans ses formes les plus graves.
« Les souris déficientes pour TLR8 développent un lupus, parce que la perte de fonction de TLR8 conduit à une augmentation de l'activité de TLR7, qui semble induire en retour une sensibilité accrue à certains composés » souligne Lena Alexopoulou.
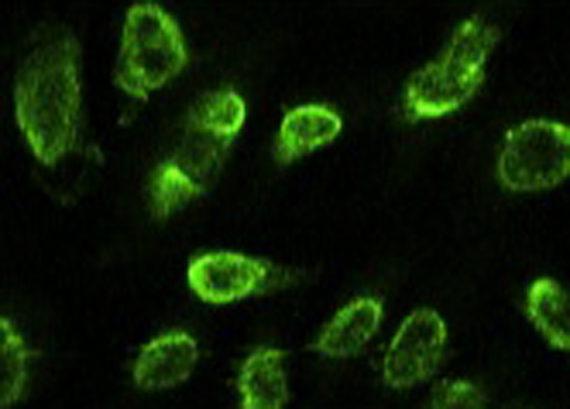
Les souris defiscientes en TLR8 développe un Lupus (détection par immuno-fluorescence des anticorps dirigés contre des constituants du noyau des cellules). Copyright Lena Axelopoulou, CIML.
Ainsi, il semble intéressant d'élucider le rôle de TLR8 dans le LED, plus particulièrement de révéler chez les patients une éventuelle corrélation entre déficience de TLR8. et LED. Les médecins pourraient alors détecter et mesurer cette anomalie pour affiner leur diagnostic et évaluer le pronostic de la maladie.
La coopération entre TLR est importante pour
nous protéger contre les infections
Pour se déplacer dans leur milieu, les bactéries utilisent des structures en forme de fouets baptisées flagelles, composées majoritairement de monomères de flagelline. La reconnaissance de la flagelline par TLR5 signale la présence de bactéries pathogènes et déclenche en retour une réponse immunitaire qui nous protège contre des infections bactériennes potentiellement graves.
Cependant, les souris dépourvues de TLR5 ne sont pas particulièrement sensibles aux infections, à moins d’être également déficientes en TLR4, qui reconnaît un tout autre composé bactérien. Ainsi, la coopération entre différents TLRs est parfois importante pour nous protéger contre les infections.
Ces deux approches très différentes de l’étude de la biologie des TLRs illustrent bien la complexité de ce système inné de protection contre les infections :
- Les effets néfastes liés à une perte de contrôle de son activité.
- Sa capacité à intégrer différents signaux reçus simultanément pour conduire à une réponse immunitaire optimale.