Décrypter les premiers signes de l'activation des lymphocytes B pour proposer de nouvelles stratégies de vaccination
Les cellules B, avec une myriade d'autres cellules immunitaires, participent à la protection des individus contre le développement de maladies graves après exposition aux pathogènes. Les cellules B nous empêchent de devenir malade en sécrétant des molécules spécifiques appelées anticorps, capables de neutraliser les pathogènes au cours de l'infection. Décrypter comment et quand ces anticorps protecteurs sont générés et comment le système immunitaire régule leur production, est essentiel dans le développement de stratégies alternatives de vaccination.
"Le réseau cellulaire dynamique des ganglions lymphatiques fournit un échafaudage sur lequel les cellules B font de l'auto-stop pour arriver à une station centrale, les centres germinatifs, dans lesquels elles sont programmées à produire des anticorps protecteurs"
Les cellules B rencontrent initialement les agents infectieux dans de petits organes appelés ganglions lymphatiques. Ces organes se trouvent partout dans le corps et ce sont eux qui gonflent lorsque nous tombons malades, preuve que notre système immunitaire fonctionne bien. Nous savions qu'après avoir été en contact avec des microorganismes étrangers, les cellules B devaient voyager dans différentes zones des ganglions lymphatiques et collecter des signaux nécessaires pour commencer à produire les anticorps. Cependant, nous ne connaissions pas exactement la nature et la source des signaux requis par les cellules B pour voyager d’une gare à l’autre. C'est ce que Mauro Gaya et ses collaborateurs ont cherché à découvrir et ils ont réussi : leur travail a fait la couverture de la prestigieuse revue scientifique Cell en janvier 2018.

Illustration montrant les cellules NKT en train de délivrer des signaux innés (jaunes) aux cellules B activées, qui vont à leur tour produire les anticorps protecteurs lors d’une infection.
Copyright : Rémi Duval Cell.
L’avènement des technologies d’imagerie de pointe et le domaine sans cesse croissant de la transgénèse ont conduit Mauro Gaya à élucider certaines énigmes du réseau cellulaire complexe des ganglions lymphatiques et à identifier les principaux acteurs sur la voie de la production d’anticorps. Mauro Gaya a identifié une population, petite mais importante, de lymphocytes appelés cellules NKT (Natural Killer T ou NKT), qui fournissent des signaux précoces et dédiés aux seules cellules B, essentiels pour leur arrivée à la station centrale, les « centres germinatifs », où la fabrication des anticorps se déroule.
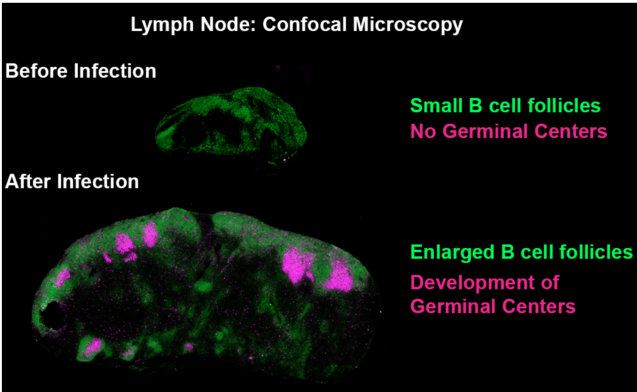
Images de microscopie confocale montrant la formation des centres germinatifs après une exposition aux pathogènes. Vert : B220 Pacific Blue, Magenta : GL-7 Alexa Fluor 647.
Copyright : Mauro Gaya, Cell.
"Augmenter nos réponses immunitaires lors d'une infection primaire peut nous rendre temporairement sensible aux agents pathogènes opportunistes secondaires "
L'un des premiers symptômes que nous éprouvons lorsque nous sommes atteints d’une infection est le gonflement de nos ganglions. L'augmentation de la taille de ces organes permet d'accueillir un grand nombre de cellules immunitaires prêtes à combattre les microorganismes envahisseurs. Ce phénomène est étroitement régulé et implique un remodelage extraordinaire de l'architecture des ganglions lymphatiques. Nous avons constaté que dans le cadre de ce remodelage, la couche de macrophages placée dans la surface externe des ganglions lymphatiques est temporairement perturbée. Comme cette couche de macrophages est essentielle pour capturer et retenir les agents pathogènes pénétrant dans les ganglions lymphatiques, le phénomène perturbateur observé lors de l'infection primaire empêche le ganglion de traiter un second cycle d'exposition pathogénique jusqu'à ce que ces macrophages aient retrouvé leur état protecteur. Si les ganglions lymphatiques cessent momentanément de fonctionner correctement après une attaque pathogénique primaire, cela signifie que les lymphocytes B ne produiront plus d’anticorps neutralisants pendant un certain temps, laissant l’hôte à la merci de potentiels microbes opportunistes secondaires. Qu'est-ce que cela signifie pour notre protection contre une exposition ultérieure aux pathogènes ? Comment pouvons-nous utiliser cette information pour générer un meilleur calendrier de vaccination ? De meilleures stratégies de vaccination ?

Images 3D de microscopie à deux-photons montrant la migration des macrophages SCS (vert) vers l’intérieur du ganglion après exposition aux signaux inflammatoires. Cyan : collagène, signal second harmonique. Vert : CD169, Alexa Fluor 647. Copyright : Mauro Gaya, Science.
Le travail de Mauro Gaya contribue à l’optimisation des programmes de vaccination.
La vaccination est un processus par lequel les individus sont immunisés contre le développement de maladies graves par l'administration de vaccins. L'immunité que procure la vaccination à large échelle a conduit à l'éradication de la variole à l’échelle mondiale et à l'élimination de maladies telles que la polio et la diphtérie dans la plupart des pays du monde. Lors d'une vaccination active, le vaccin contient des antigènes modifiés et les individus activent leur propre système immunitaire pour synthétiser leurs propres anticorps. Lors de la vaccination passive, le vaccin contient des anticorps préformés et les individus ne produisent pas leur propre stock, mais se servent uniquement des anticorps perfusés.
La vaccination active est aujourd’hui la plus intéressante. Par conséquent, la plupart des vaccins humains actuellement homologués reposent sur l'induction d'anticorps à haute affinité capables de neutraliser les agents pathogènes infectieux en cas d'exposition. Cependant, la production de vaccins contre certains types de virus, tels que le virus de la grippe et le VIH, ne permet pas d’assurer une protection durable car ces virus sont dotés de plusieurs types de souches capables de muter génétiquement. En raison de l'absence de vaccins à protection croisée contre ces virus dits variants, il existe un besoin médical immédiat : développer de nouvelles approches thérapeutiques capables de nous protéger efficacement contre ce type de virus. Une compréhension plus approfondie des mécanismes cellulaires et moléculaires lors de l'activation des cellules B en réponse à une infection est donc essentielle dans le développement de vaccins de la nouvelle génération.
« Peut-on développer des vaccins qui élargissent le spectre de protection immunitaire à partir d’une étude fondamentale sur l’activation des cellules B pendant une infection ? » En s’appuyant sur des techniques d'imagerie de pointe, la cytométrie en flux multiparamétrique, des modèles d'infection in vivo et la génération de nouvelles lignées de souris transgéniques, c’est ce que l’équipe de Mauro Gaya est en train de mettre au point. Les nouvelles données de recherche permettront aux cliniciens de réviser leurs programmes de vaccination pour mieux répondre aux besoins cliniques.