En désactivant les « interrupteurs à gènes » MafB et c-Maf, l’équipe franco-allemande de Michael SIEWEKE (CIML et Centre de Médecine Moléculaire de Max Delbrück de Berlin-Buch) avait précédemment montré que des cellules immunitaires matures comme les macrophages étaient capables de se multiplier quasi indéfiniment.
Cette fois, elle démontre qu’ils sont capables de s’auto-renouveler sans aucune manipulation génétique. Comme les scientifiques le révèlent dans l’édition en ligne de Science du 21 janvier les macrophages activent à cette fin un réseau de gènes similaire à celui des cellules souches embryonnaires. Cette découverte inattendue pourrait ouvrir de nouvelles perspectives en matière de médecine régénératrice et de thérapies.
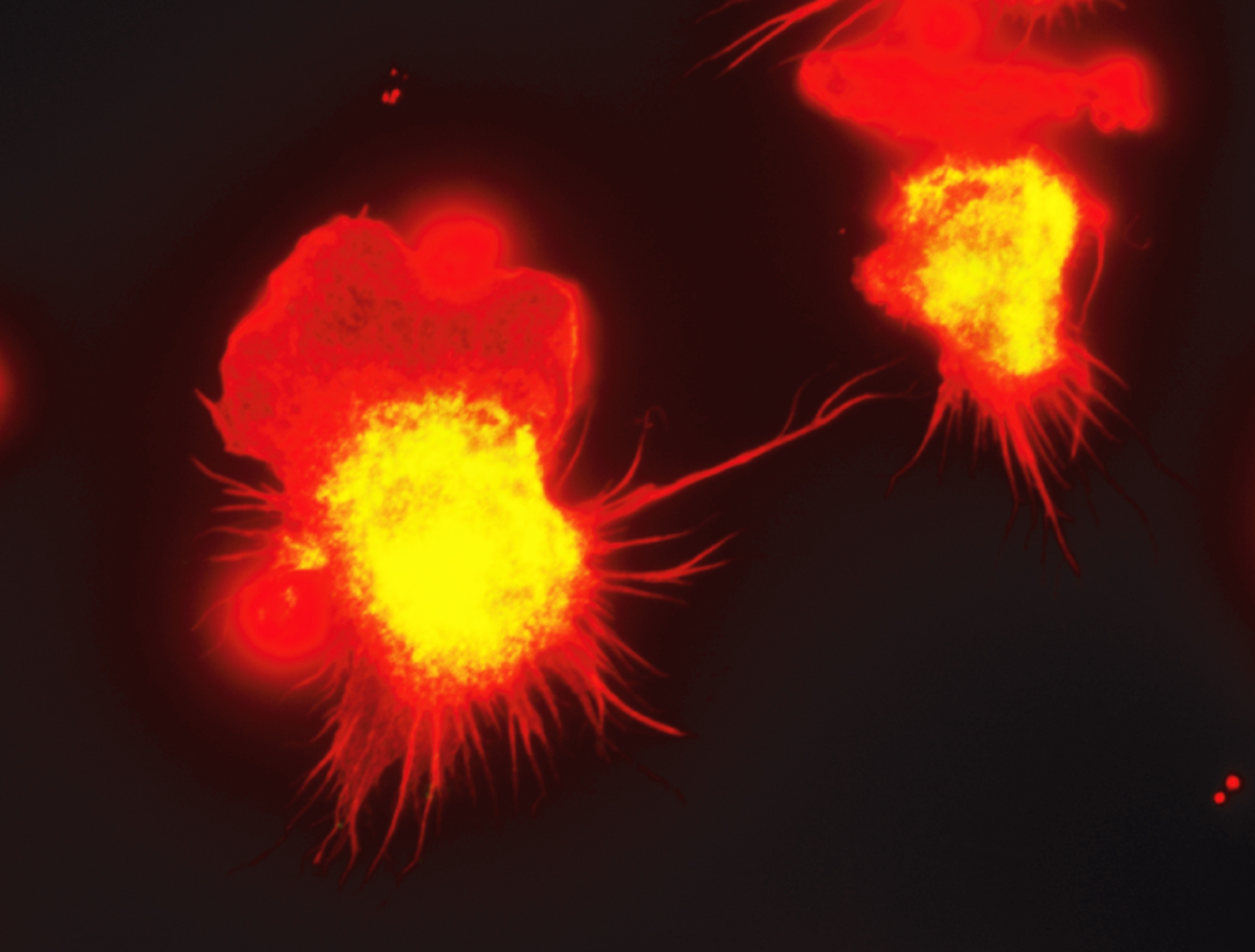
Les tissus de notre organisme se composent de cellules différenciées qui doivent en permanence être remplacées, un vrai challenge pour certaines populations cellulaires exposées aux agressions de notre environnement comme les cellules immunitaires. Il est généralement admis que la capacité de s’auto-renouveler et de fabriquer massivement des cellules pour maintenir ou réparer les tissus est une spécificité des cellules souches embryonnaires. L’équipe de Michael Sieweke démontre aujourd’hui que « ces propriétés propres aux cellules souches » sommeillent aussi dans certaines cellules différenciées.
Il y a quelques années, ell avait déjà montré qu’en « éteignant » deux régulateurs cellulaires, les facteurs de transcription MafB et c-Maf, dans les macrophages, ces derniers devenaient capables de se multiplier en culture quasi indéfiniment. Dans cette nouvelle étude, elle révèle cette fois que des macrophages peuvent également s’auto-renouveller sans aucune manipulation génétique.
Dans certaines conditions, les macrophages réactivent un pool
de gènes silencieux qui leur confère alors la capacité
de s’auto-renouveler
Pour comprendre les processus fonctionnels à l’origine d’une telle prouesse, l’équipe a comparé les mécanismes génétiques à l’œuvre dans les cellules souches embryonnaires et ces macrophages dotés de capacités d’auto-renouvellement. « Nous avons alors découvert que ces macrophages activent un ensemble de gènes similaires à celui que les cellules souches embryonnaires utilisent pour se diviser » révèle Michael Sieweke.
Bien que les réseaux actifs de gènes soient similaires dans les deux types de cellules, leur gestion diffère de bien des façons : ils sont contrôlés par des facteurs de transcription et des éléments régulateurs spécifiques de chacun de ces types de cellules. « En réalité, c’est plutôt une bonne nouvelle de constater que des cellules matures comme les macrophages peuvent activer des gènes d’auto-renouvellement similaires à ceux des cellules souches en utilisant leurs propres systèmes de régulation » souligne Michael Sieweke. Et d’ajouter « En clair, cela signifie que nous pouvons amplifier ces cellules sans changer leur identité ».
De nouvelles perspectives en matières
de médecine régénératrice
Michael Sieweke est convaincu que ces découvertes pourraient déboucher à terme sur des applications utiles dans le domaine de la médecine régénérative. « Si des cellules différenciées pouvaient être produites directement, il deviendrait alors envisageable de remplacer des tissus malades en s’affranchissant des cellules souches embryonnaires ou des cellules souches induites ” déclare Michael Sieweke.
Au vu de leur rôle dans la maintenance et la régénération tissulaire, la transplantation des macrophages eux-mêmes pourrait également permettre de stimuler la régénération dans des indications où la thérapie par cellules souches a été envisagée ou testée : l’infarctus du myocarde et certaines maladies pulmonaires ou musculaires. Dans ce sens, l’équipe a déjà démontré que les macrophages cultivés en laboratoire conservaient leurs propriétés : une fois réinjectés dans des souris, ils réintègrent sans incident les tissus et remplissent normalement leurs fonctions.

Source:
Activation of Self-Renewal Gene Network on a Macrophage-Specific Enhancer Platform
Erinn L. Soucie, Ziming Weng, Laufey Geirsdóttir, Kaaweh Molawi, Julien Maurizio, Romain Fenouil, Noushine Mossadegh-Keller, Gregory Gimenez, Laurent VanHille, Meryam Beniazza, Jeremy Favret, Pierre Perrin, Nir Hacohen, J.-C. Andrau, Pierre Ferrier, Patrice Dubreuil, Arend Sidow, Michael H. Sieweke.
Plus d’informations sur l’équipe