Membres











À propos
Responsable d’équipe : Dr Achille Broggi
L’intestin : un organe clé pour notre santé
L’intestin n’est pas seulement un organe de digestion : c’est aussi un acteur essentiel de notre défense contre les microbes. Il est tapissé d’un épithélium — une fine couche de cellules — qui agit comme une barrière protectrice. Cet épithélium est constamment exposé à des milliards de microbes : certains sont bénéfiques (le microbiote), d’autres peuvent être dangereux (les agents pathogènes). Pour rester en bonne santé, l’intestin doit garder un équilibre fragile entre défense, réparation et tolérance.
Quand cet équilibre est rompu, la barrière se fragilise, ce qui favorise les infections et peut conduire à des maladies chroniques comme les MICI (maladies inflammatoires chroniques de l’intestin, par exemple la maladie de Crohn).
Notre équipe cherche à comprendre comment les cellules immunitaires, les cellules épithéliales et les microbes intestinaux communiquent entre eux pour maintenir cet équilibre.
Axe 1 : Les interférons de type III – Une protection qui peut parfois devenir nocive
Responsable : Dr Achille Broggi
Les interférons de type III (IFN-λ) sont des molécules produites lors des infections, surtout virales. Elles aident à défendre l’intestin en protégeant les cellules et en limitant l’inflammation.
Mais si ces molécules sont produites trop longtemps ou au mauvais moment (par exemple en réponse à un microbiote déséquilibré), elles peuvent bloquer les processus de réparation et entretenir l’inflammation.
Nous étudions comment fonctionnent ces interférons, pour mieux comprendre quand et comment ils aident ou nuisent à la santé de l’intestin, et comment on pourrait les réguler pour éviter les effets négatifs.
Axe 2 : Malnutrition et immunité intestinale
Responsables : Dr Julie Tomas, Dr. Achille Broggi
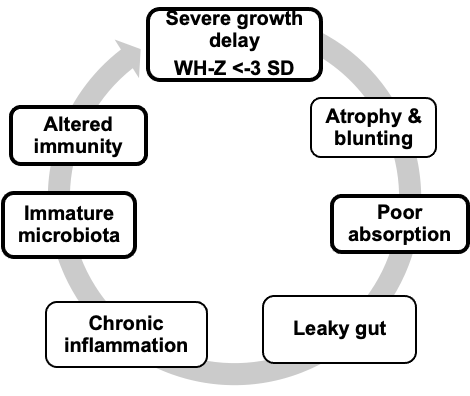
La malnutrition, notamment chez les enfants, rend l’intestin plus fragile. Elle affaiblit le système immunitaire, modifie le microbiote, et réduit l’efficacité des vaccins.
Nous cherchons à comprendre comment la malnutrition perturbe les défenses intestinales, et comment on pourrait les restaurer.
Nous testons des solutions comme l’utilisation de probiotiques ou de molécules bénéfiques pour renforcer l’immunité et améliorer l’efficacité des traitements nutritionnels, notamment chez les enfants vulnérables.
Axe 3 : Vitamine B5 et réparation de l’intestin
Responsables : Prof. Franck Galland, Dr.Achille Broggi
Pour se réparer, les cellules de l’intestin ont besoin d’énergie. Cette énergie est produite par des structures appelées mitochondries, un peu comme les “centrales électriques” des cellules.
Nous avons découvert qu’une enzyme appelée Vnn1, produite dans l’épithélium, aide à transformer les nutriments en vitamine B5, un élément clé pour le bon fonctionnement des mitochondries.
En boostant cette voie métabolique, Vnn1 améliore la capacité de la barriere intestinale à se réparer.
Nos travaux visent à mieux comprendre cette interaction entre métabolisme, microbiote et réparation, pour proposer de nouvelles approches thérapeutiques.
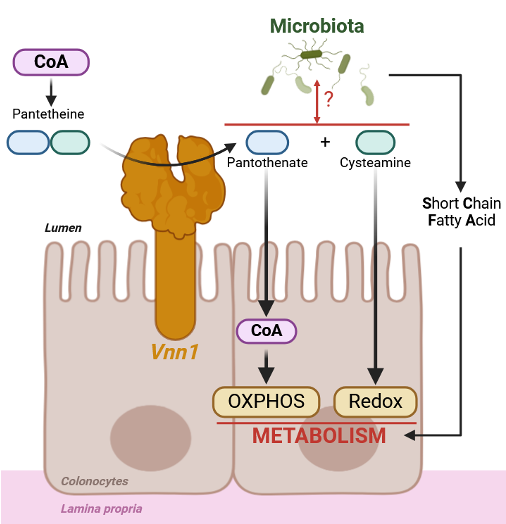
Ces trois axes — immunité antivirale, nutrition et métabolisme cellulaire — sont complémentaires. Ensemble, ils nous permettent de mieux comprendre comment garder un intestin en bonne santé, capable de se défendre et de se réparer efficacement.
Nos recherches ont des applications concrètes pour le traitement des infections, des maladies inflammatoires de l’intestin et des effets à long terme de la malnutrition, en particulier chez les enfants.
Actualités

Le chargé de recherche CNRS du Centre d’immunologie de Marseille-Luminy est récompensé pour ses travaux sur les interférons et la […]
Une équipe de chercheurs du Centre d’Immunologie de Marseille-Luminy (CIML), dirigée par le Dr Achille Broggi, en collaboration avec le […]
Projets
Project : INTERMUQUEUSE Ce projet explore le rôle d’une molécule du système immunitaire appelée interféron de type III (IFN-λ). Cette […]



Project : ICARO Les vaccins acellulaires actuels sont surtout efficaces contre les pathogènes extracellulaires, mais échouent à induire une réponse […]